靶向巨噬细胞的肿瘤免疫治疗新方法
肿瘤转移是癌症患者死亡的主要原因。肿瘤相关巨噬细胞被认为通过多种机制在促进肿瘤发生和转移方面发挥核心作用。近年来,巨噬细胞多样起源已被广泛认同。现在已经将卵黄囊红髓细胞祖细胞 (EMP) 确定为稳态下组织驻留巨噬细胞的来源。这些组织巨噬细胞在成年组织中自我维持,较少依赖骨髓造血干细胞 (HSCs) 和单核细胞的输入。在肿瘤转移肝脏微环境中,巨噬细胞的多样性起源、空间分布、它们对肿瘤转移的贡献以及分子机制尚不清楚。
针对上述问题,近日,纪念斯隆-凯特琳癌症中心 Frederic Geissmann 教授团队在 Nature 期刊发表了题为:The nuclear factor ID3 endows macrophages with a potent anti-tumour activity 的研究论文。揭示了靶向巨噬细胞肿瘤免疫治疗的新方法。
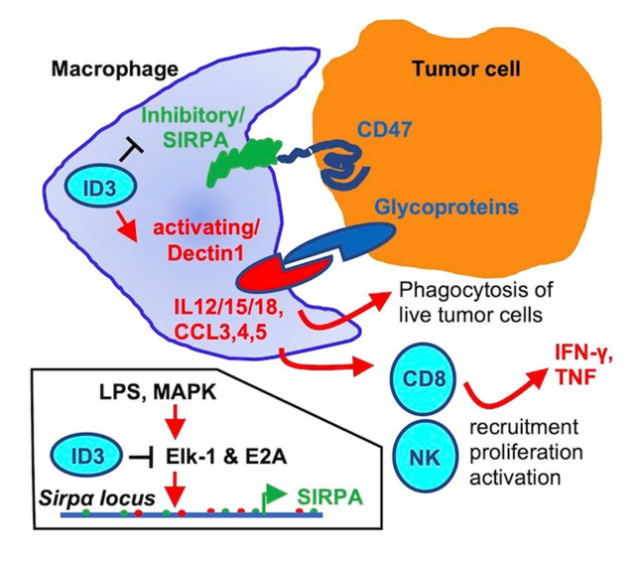
靶向巨噬细胞作用机制(图片来源:Nature)
通过研究发现巨噬细胞异质性表面标志物表达量的高低,我们得以在肿瘤转移肝脏微环境中区分组织驻留Kupffer细胞和肿瘤相关巨噬细胞,利用谱系示踪技术以及联体共生实验系统性阐述了肿瘤转移肝脏微环境中巨噬细胞具备异质发育起源,其中驻留Kupffer细胞起源于卵黄囊,肿瘤相关巨噬细胞则起源于造血干细胞,即使在肿瘤浸润的过程中,这两类巨噬细胞依然维持各自的细胞谱系,并不会彼此转换各自的细胞谱系。通过免疫荧光技术、流失细胞技术以及单细胞测序技术,在小鼠自发转移的内源性肿瘤模型 、小鼠原位移植模型、5种肿瘤细胞门静脉注射诱发的小鼠肝转移模型,以及病人胰腺癌肝转移样本中,我们发现肿瘤转移肝脏微环境中巨噬细胞具备迥异空间分布,其中肝脏驻留Kupffer 细胞分布于肿瘤外,并紧紧包裹住肿瘤,肿瘤相关巨噬细胞则位于肿瘤内。为进一步研究这两群巨噬细胞在应对肿瘤转移到肝脏中的贡献,该研究开发了遗传工具小鼠,分别选择性敲除驻留Kupffer 细胞以及肿瘤相关巨噬细胞,随后,在这些遗传工具小鼠中诱发肝脏肿瘤转移。通过活体成像生物发过技术、免疫组织化学技术以及流式细胞技术综合分析肿瘤负荷,发现驻留Kupffer 细胞缺陷小鼠与对照组相比,肿瘤负荷显著增加。而肿瘤相关巨噬细胞缺陷小鼠,肿瘤负荷并无显著变化,证明了肿瘤转移肝脏微环境中巨噬细胞具备不同的抗肿瘤功能,其中驻留Kupffer 细胞具备强大的抗肿瘤功能。
接下来,该研究专注于Kupffer细胞抗肿瘤机制研究。通过体内和体外的实验手段,凋亡抑制因子(D89E)抑制实验,小鼠体内活细胞荧光延时成像技术、以及体外活细胞荧光延时成像技术结合细胞凋亡/死亡报告探针(Caspase-3/7 reporter)系统证明了肝脏Kupffer细胞可以直接吞噬/杀死活的肿瘤细胞。进一步分析,该研究发现了一个由 Kupffer细胞组成位于肿瘤/肝脏边界,并依赖于谱系决定因子ID3的抗肿瘤免疫屏障。在肿瘤/肝脏边界,1. Kupffer细胞持续吞噬/杀死活的肿瘤细胞以及肿瘤起始细胞。2. Kupffer细胞通过肿瘤识别激活性受体/抑制性受体识别肿瘤细胞后,被激活并原位分泌趋化因子(CCL3,CCL4, CCL5)与细胞因子(IL12,IL15,IL18),招募并激活NK细胞与CD8阳性T细胞富集在肿瘤/肝脏边界,进一步杀死肿瘤细胞。3. ID3 至少部分地通过缓冲转录因子 ELK1 和 E2A在稳态和炎症条件下与 Sirpα 增强子/启动子的结合来改变巨噬细胞抑制/激活受体平衡,降低 SIRPA 表达,上调Dectin1表达,从而形成强大的抗肿瘤免疫屏障(下图)。这一发现具备广谱的意义,在小鼠骨髓来源巨噬细胞以及人诱导多能干细胞来源的巨噬细胞高表达ID3之后,显著提升了它们在各种肿瘤模型中抗肿瘤能力。
总之,该研究阐明了ID3在调控巨噬细胞抗肿瘤过程中新机制,为肝脏及其他肿瘤的免疫治疗提供了新的潜在方法。
原文链接:https://www.nature.com/articles/s41586-023-06950-4
关联产品:
人白介素15低表达NSG小鼠
人白介素15高表达NSG小鼠
Caspase-3/7活性检测试剂盒
SIRPA ELISA试剂盒

